La pasteurellose est une maladie infectieuse, due à Pasteurella multocida, affectant de nombreuses espèces d’oiseaux. Elle doit son nom à Louis Pasteur, qui a précisé les caractéristiques du germe en cause, lequel avait été découvert dès 1879 par Toussaint. On rencontre la maladie dans le monde entier, sous forme sporadique ou enzootique, aiguë ou chronique sous la forme d’une maladie systémique avec une forte mortalité et une forte morbidité.
L’agent de la maladie et son pouvoir pathogène
Pasteurella multocida est une bactérie Gram négative, immobile, capsulée, extracellulaire, à la fois aérobie et anaérobie. La structure antigénique de la bactérie est complexe. Elle est composée d’un antigène capsulaire = antigène K, qui masque l’antigène de paroi ou antigène somatique = antigène O. La bactérie est très sensible aux UV, à la dessiccation, aux désinfectants usuels, et ne résiste que quelques jours en milieu extérieur.
La classification est complexe. On peut tout d’abord séparer les souches de pasteurelle en trois sous espèces : P. multocida multocida, P. multociada septica et P. multocida gallicida. Les trois peuvent être retrouvées lors de pasteurelloses aviaire mais la plus fréquente reste la première. D’autres classifications plus précises existent. La classification de Carter distingue 4 types d’antigènes K : A, B, C et D (A étant la plus fréquente en aviculture). L’antigène O permet de classifier les pasteurelles sous différents sérotypes, variables selon les classifications. Selon la classification de Namioka, l’antigène O compte 12 sérotypes (1 à 12) et on classe ainsi la pasteurelle selon la combinaison des sérotypes capsulaire et somatique. La classification de Heddleston, largement répandue hors de France, distingue 16 sérotypes (1 à 16), mais ne montre aucune concordance avec la classification Namioka (des sérotypes différents selon Namioka peuvent correspondre au même sérotype selon Heddleston).
La pathogénie est complexe. Il s’agit d’une toxi-infection, provoquant une augmentation de la perméabilité des capillaires avec des troubles hydriques, et des troubles des échanges énergétiques des cellules. La virulence des pasteurelles est liée à la souche bactérienne, mais aussi à d’autres facteurs (espèce aviaire réceptive, voie d’inoculation, environnement) et nécessite la présence de la capsule bactérienne. Les formes aiguës sont dues à des souches très virulentes qui produisent une grande quantité d’endotoxines. L’immunité mise en jeu est plutôt de type humoral.
Les données épidémiologiques
De nombreuses espèces d’oiseaux sont sensibles à P. multocida. On rencontre surtout la maladie chez la dinde, le canard, l’oie et le poulet. L’homme peut être accidentellement contaminé par une lésion cutanée. C’est une affection des oiseaux adultes ou jeunes adultes, mais la maladie peut apparaître dès 4 semaines. Les reproducteurs sont plus fréquemment atteints. Il existe de nombreux porteurs sains parmi l’avifaune sauvage.
De nombreux facteurs favorisent l’apparition et le développement de l’infection dans un élevage. Les facteurs environnementaux sont prépondérants, surtout le froid. La pasteurellose est plus souvent rencontrée à la fin de l’été, en automne et en hiver. La bactérie persiste longtemps et facilement dans des sols frais et humides. Des stress, comme le dégriffage, le débecquage, les vaccinations, la mise en gavage, sont aussi très favorisants.
La transmission est horizontale, indirecte (insecte, matériel,…) mais surtout directe. Il ne semble pas exister de transmission verticale.
Les réservoirs de P. multocida peuvent être des oiseaux de l’élevage infecté (porteurs chroniques ou survivants), ou des oiseaux sauvages pénétrant dans l’élevage, on suspecte aussi les rats, les cochons et les mammifères domestiques. Les matières virulentes sont les sécrétions buccales, nasales, conjonctivales. Toutes les déjections et souillures des oiseaux malades sont contaminantes. La bactérie se multiplie facilement dans les cadavres. La voie de pénétration est principalement aérienne, mais les voies orale, conjonctivale et cutanée sont possibles.
Les manifestations cliniques de la maladie
Compte tenu de la variabilité du pouvoir pathogène des souches et de la résistance des oiseaux, la pasteurellose présente un grand polymorphisme clinique et lésionnel.
Symptômes
- La forme suraiguë peut être foudroyante. Lors d’évolution moins brutale, on observe une prostration intense, une hyperthermie ; la crête et les barbillons sont violacés. La mort survient en 3 à 6 heures.
- La forme aiguë s’accompagne d’une hyperthermie, d’anorexie, de plumes ébouriffées,de tremblements, d’une respiration rapide et bruyante, de jetage ; la crête, les barbillons et les zones déplumées sont cyanosés juste avant la mort. On a aussi une diarrhée abondante, malodorante, verdâtre devenant hémorragique. Certains oiseaux peuvent présenter un torticolis ou des vomissements. La mort survient en 2-8 jours. Si les animaux survivent à ces signes initiaux ils peuvent néanmoins mourir des effets débilitants de la déshydratation, présenter une forme chronique ou récupérer.
- Dans la forme chronique, les signes varient selon la localisation de l’infection : abcès pasteurelliques (arthrite, maladie des barbillons chez le poulet), pharyngite, conjonctivite, infection de l’oreille moyenne (avec torticolis chez le dindon), forme respiratoire (manifestation la plus fréquente prenant l’allure d’une maladie respiratoire chronique avec des râles trachéaux et de la dyspnée). Cette forme apparait toujours après une phase aiguë.
Lésions
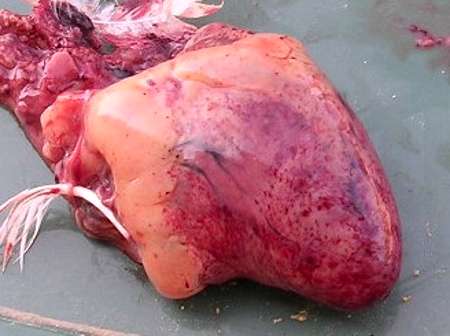
- Dans la forme suraiguë, on retrouve des lésions non spécifiques de septicémie hémorragique : congestion généralisée, lésions hémorragiques (surtout sur le gésier, le cœur, l’intestin grêle, les poumons, les reins et la rate). On observe aussi un exsudat hémorragique dans les cavités péricardique et péritonéale.
- Dans la forme aiguë, certaines lésions s’ajoutent aux lésions septicémiques : foie congestionné avec un piqueté hémorragique puis blanc jaunâtre, des lésions de pneumonie avec foyers de nécrose jaunâtres dans le parenchyme pulmonaire, en particulier chez les dindons et les canards. D’autres organes peuvent être atteints, comme l’intestin (entérite fibrineuse), le jabot et le pharynx (dépôt muqueux) ou la grappe ovarienne (ponte abdominale chez les reproducteurs).
- Dans la forme chronique, les lésions sont localisées aux barbillons (œdème de la face), aux articulations, à la bourse sternale, aux coussinets plantaires, à l’oreille moyenne (pouvant évoluer en torticollis), à l’ovaire, au foie (périhépatite), aux os du crane (dépôt fibrineux) ou à l’appareil respiratoire (sinusite infra-orbitaire, pneumonie, aérosacculite , affection des os pneumatisés).
Le diagnostic
Diagnostic clinique
Il est difficile. On peut le suspecter quand une mortalité forte et subite atteint les oiseaux de plusieurs espèces dans un élevage, surtout lorsque les palmipèdes sont atteints en premier. L’autopsie ne peut pas apporter la confirmation, même lors de l’observation de piquetés sur le foie associés aux lésions cardiaques et intestinales.
Diagnostic différentiel
Il concerne de nombreuses affections. Il faut différencier la pasteurellose de l’influenza aviaire hautement pathogène ( !), la maladie de Newcastle, les salmonelloses aviaires, la peste du canard, la rhinotrachéite infectieuse (infection à metapneumovirus), du rouget du dindon, ainsi que toutes les affections respiratoires, notamment les infections dut à Avibactrium gallinarum et Gallibacterium anatis biovar haemolytica, qui sont des bactéries proches.
Diagnostic de laboratoire
On isole P. multocida à partir de la moelle osseuse, du foie, du sang cardiaque, des lésions localisées, d’écouvillons des cavités nasales. Un antibiogramme est souvent nécessaire pour définir le profil de sensibilité aux antibiotiques. Les examens sérologiques (ELISA) ont un intérêt limité. Ils sont tout au plus indiqués pour effectuer un suivi -grossier- de la réponse vaccinale.
La prévention et le contrôle de la maladie
Traitement
S’il est rapidement mis en place, il est efficace lors de formes aiguës, mais il est décevant lors de formes chroniques et trop tardif lors de formes suraiguës.
On traite par antibiothérapie en s’appuyant sur un antibiogramme, associée à des vitamines (A, B et C). On utilisera principalement les quinolones (acide nalidixique, acide oxolinique, fluméquine, enrofloxacine), les céphalosporines (ceftiofur), la spectinomycine, l’amoxicilline (20 mg/kg PV), les tétracyclines (doxycycline, chlortetracylcine à 40mg/kg), les phénolés (chloramphénicol à 20mg/kg). Le traitement est appliqué pendant au moins 5 jours, et doit être adapté selon les résultats de l’antibiogramme.
Prophylaxie sanitaire
Difficile à mettre en place. Elle consiste à éliminer les sources potentielles de P. multocida (oiseaux malades ou convalescents, rats, autres oiseaux,…), à prévenir la contamination des aliments et de l’eau de boisson, à éviter les mélanges d’espèces, d’âge.
Prophylaxie médicale
Consiste en la chimioprévention et/ou la vaccination. La chimioprévention peut être conseillée dans les élevages atteints de manière récurrente. La vaccination repose sur l’utilisation de vaccins à agent inactivé. On peut utiliser des vaccins commerciaux comprenant les valences les plus répandues, ou des autovaccins.







