Les mycoplasmoses aviaires sont des infections respiratoires, génitales ou articulaires. Ce sont des maladies insidieuses, courantes, qui ont néanmoins régressé ces dernières années, suite aux efforts d’éradication dans les troupeaux reproducteurs. Elles entraînent de lourdes pertes économiques.
L’agent de la maladie et son pouvoir pathogène
L’agent étiologique de la mycoplasmose est un mycoplasme. C’est une petite bactérie de 0.2 à 0.5 µm de diamètre, sans paroi. Elle n’est pas visible en microscopie optique. Les mycoplasmes sont difficiles à cultiver. Ils agglutinent les globules rouges.
De par leur absence de paroi, les mycoplasmes sont résistant à de nombreux antibactériens, notamment les b-lactamines. Ils sont par contre sensibles à la plupart des désinfectants usuels. Les mycoplasmes ne peuvent survivre que quelques jours en dehors de leur hôte.
Il existe de nombreuses espèces, dont la pathogénicité et le spectre d’hôtes sont variables. Les principales espèces d’intérêt en pathologie aviaire sont : Mycoplasma gallisepticum (MG), M. meleagridis (MM) et M. synoviae (MS).
Les données épidémiologiques
M. gallisepticum
Provoque une maladie respiratoire chronique chez le poulet et une sinusite infectieuse chez la dinde. MG a également été isolé aussi chez le pigeon, le canard, l’oie, le faisan, la perdrix, la caille et les oiseaux sauvages. Les jeunes sont plus sensibles que les adultes.
L’infection est exacerbée par une infection bactérienne ou virale préalable (maladie de Newcastle, bronchite infectieuse, LTI), par un stress (vaccinations, autres interventions…) et surtout, par une mauvaise ambiance (NH3 élevé, poussières).
Les mycoplasmoses sont souvent associées à d’autres infections et/ou à des conditions de milieu favorisantes.
Comme la bactérie survit peu de temps en milieu extérieur (1 à 3 jours à 20°c), les oiseaux porteurs sont nécessaires pour la pérennité de la maladie. La transmission est verticale, et horizontale directe (par les jeunes infectés, les oiseaux sauvages) ou indirecte (contamination de l’environnement). Les basse-cours sont souvent infectées de manière subclinique : ce sont un réservoir du pathogène. De plus, l’élevage en multi-âge est un facteur de risque majeur.
M. meleagridis
Provoque une infection chez la dinde. Le germe a un tropisme pour la bourse de Fabricius et provoque une immunosuppression. Les jeunes sont plus sensibles que les adultes.
La transmission peut être verticale. Elle est aussi horizontale par voie respiratoire : l’infection reste alors localisée au niveau respiratoire la plupart du temps. Elle peut aussi être horizontale par les mains contaminées du manipulateur lors du sexage ou lors de l’insémination artificielle. Chez les porteurs, le germe est isolé essentiellement dans les organes génitaux et le sperme. Les porteurs disparaissent souvent après une saison de reproduction.
M. synoviae
Entraîne une synovite infectieuse chez le poulet, la dinde et la pintade.
Les jeunes sont plus sensibles que les adultes. Les poulets de chair sont touchés de manière aigüe surtout entre 4 et 16 semaines d’âge, les dindons entre 10 et 24 semaines. Une infection chronique peut s’installer et persister toute la vie du lot. Les cas sont plus nombreux pendant les périodes froides et humides.
La bactérie se localise dans les tendons, les articulations, les ovaires et à un moindre degré, dans le tractus respiratoire.
La fréquence des cas tend à diminuer actuellement. Cependant, une forme clinique est en augmentation : le syndrome des œufs à extrémité de verre, qui se caractérise par une fragilité de la coquille, notamment à l’apex de l’œuf, chez les poules pondeuses.
La transmission est surtout verticale (transovarienne), mais aussi horizontale, via les aérosols.
Les manifestations cliniques de la maladie
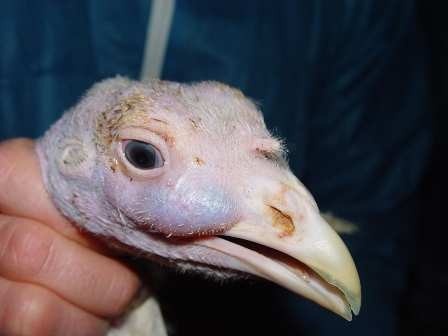
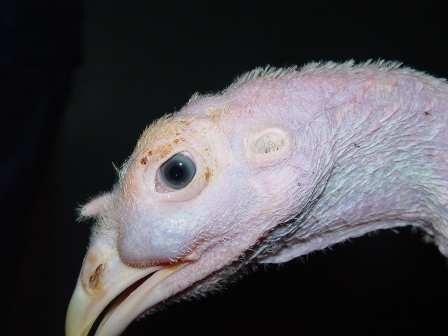
M. gallisepticum
La phase d’incubation est de 6 à 21 jours. Les signes cliniques persistent souvent longtemps et sont provoqués par un changement. Ils sont plus sévères chez les jeunes et chez la dinde.
Symptômes
- Chez la dinde, on peut avoir de la toux, de l’éternuement, des râles, du jetage nasal et oculaire, et un gonflement des sinus infra-orbitaires (souvent, le gonflement n’est pas associé à des signes d’atteinte du système respiratoire profond).
- Chez les poulets, on peut avoir de la toux, des râles et du jetage nasal mais cette espèce est moins sensible à MG que la dinde. Les signes cliniques sont plus sévères chez les jeunes, mais n’apparaissent pas avant 4 semaines d’âge.
- Chez les poules pondeuses, on observe une diminution de la consommation alimentaire et de la ponte.
Lésions
Cachexie, inflammation catarrhale des sinus, de la trachée, des bronches, opacification des sacs aériens avec exsudat spumeux ou caséeux (forme chronique), péricardite et périhépatite fibrineuses, salpingite (dinde).
M. meleagridis
A noter : elle est devenue très rare en France.
Symptômes
Les signes cliniques sont très faibles en général. L’éclosabilité des œufs diminue. Les jeunes ont une croissance plus faible. Parfois, les dindonneaux présentent une sinusite ou une aérosacculite ; les lésions régressent alors souvent d’elles-mêmes. On observe aussi des déformations des pattes, et de l’ostéomyélite déformante des vertèbres cervicales (dindonneaux au cou tordu).
Certaines dindes présentent les signes suivants : faible croissance et mauvais emplumement, chondrodystrophie, aérosacculite et diarrhée ; c’est le « turkey syndrom 65 ».
Lésions
Petite quantité d’exsudat jaunâtre dans les sacs aériens (lésions régressives, souvent disparues à l’abattoir) ; dans le syndrome « cou tordu », les dindonneaux montrent de la spondylite et une aérosacculite au niveau du sac cervical ; dans le turkey syndrom 65, les dindes présentent de la chondrodystrophie, et un varus uni- ou bilatéral.
M. synoviae
Symptômes
Boiteries, oiseaux à terre, crêtes pâles, pattes enflées, retards de croissance, fientes vertes, infections respiratoires généralement asymptomatiques.
Lésions
On retrouve un exsudat visqueux, gris à jaunâtre dans les articulations (surtout au jarret, ailes, pieds). Lors d’infection chronique, les oiseaux sont émaciés, et présentent un exsudat sec orange à brun dans les articulations, ainsi qu’une bursite sternale (liée aux frottements du bréchet contre le sol). Certains oiseaux, sans lésions articulaires, peuvent avoir une légère trachéite, sinusite, aérosacculite.
Le diagnostic
Diagnostic de laboratoire
La sérologie est possible pour MG et MS : on réalise des tests d’agglutination en tube ou sur lame, et la distinction MG-MS se fait par inhibition de l’hémagglutination.
La culture est possible à partir d’écouvillons orbitaux, nasaux ou trachéaux, de tissus pour MG, d’embryons, d’écouvillons trachéal, cloacal, vaginal, du phallus pour MM, d’écouvillons articulaires, de prélèvements de rate ou de foie lors de cas aigus de MS, de poumons et de sacs aériens lors de cas chroniques. Cependant, la croissance des bactéries est lente, et peut prendre jusqu’à 3 semaines. Le diagnostic des mycoplasmoses par PCR est disponible en routine, notamment à l’aide de kits PCR commercialisés.
M. gallisepticum
Diagnostic clinique
Historique de chronicité, perte de poids, chute de ponte, lésions.
Diagnostic différentiel
Colibacillose, ORT, aspergillose, choléra aviaire ; chez la dinde, la sinusite peut être causée par des virus influenza faiblement pathogènes, M. synoviae.
M. synoviae
Diagnostic clinique
Boiteries, pattes enflées, lésions avec exsudat gris à jaune.
Diagnostic différentiel
Arthrites à Staphylocoques, arthrite virale, typhose, pullorose.
La prévention et le contrôle de la maladie
Le traitement des mycoplasmoses fait appel aux antibiotiques. Du fait de l’absence de paroi de ces mycoplasmes, les antibiotiques inhibant la synthèse de la paroi (pénicilline) et ceux inhibant la synthèse de la membrane sont évidemment inefficaces. Il faut utiliser plusieurs antibiotiques inhibant la synthèse de protéines en association (macrolides, doxycycline, quinolones 3ème génération). Il faut adapter les antibiotiques en fonction des résistances des mycoplasmes en cause. L’antibiothérapie doit aussi permettre de lutter contre les fréquentes co-infections bactériennes.
Éradication & prévention
- Améliorer les conditions d’ambiance, faire principalement attention aux facteurs de stress, aux teneurs en ammoniac et à la présence de poussière.
- Éviter l’introduction d’oiseaux contaminés dans un élevage indemne. L’introduction de nouveaux animaux doit se faire à partir de troupeaux reproducteurs Mycoplasma spp-free ; les reproducteurs sont suivis sérologiquement, leurs œufs sont désinfectés et peuvent être traités, les poussins sont élevés dans un milieu assaini et surveillé ( Les volailles exportées doivent être certifiées indemnes de MG et MM : ce contrôle concerne particulièrement les échanges de poussins de 1 jour).
Vaccination
- La vaccination à l’égard de MG est également utilisée dans certains pays, notamment au Maghreb. Les vaccins à agent inactivé sont peu efficaces. Les vaccins à agent vivant atténué présentent un risque de réversion vers la virulence et rendent difficile l’identification d’une contamination par un isolat sauvage pathogène.
- La vaccination à l’égard de MS, avec un vaccin à agent vivant atténué, permet un contrôle efficace du syndrome des œufs à extrémité de verre.
Autres mycoplasmes
M. iowae
On le rencontre chez les dindes principalement, mais aussi chez les poulets et les oiseaux sauvages. Les lésions sont semblables à celles de M. meleagridis. Il est devenu rare.
Mycoplasmes du canard
Il s’agit surtout de M. anatis, au rôle pathogène encore obscur. Il pourrait contribuer aux affections respiratoires non spécifiques du canard en cours de croissance.
Mycoplasmes de l’oie
Il s’agit surtout de M. anseris, son rôle pathogène est obscur. Une forme de mycoplasmose vénérienne à M. Anatis est propre aux reproducteurs : elle entraîne des lésions nécrotiques très sévères du pénis chez le mâle et des cloacites modérées chez la femelle. Les femelles sont donc essentiellement des porteuses, qui contaminent les jars. La nécrose du pénis chez un nombre significatif de jars est le signe d’appel de cette infection.







