Décrite pour la 1ère fois en 1948 au Etats-Unis, cette maladie a été décrite pour la 1ère fois en Europe en 1956.
Extrêmement contagieuse, elle se caractérise par une mortalité importante, avec ou sans troubles nerveux, chez de jeunes canetons Pékins ou mulards. Actuellement, la vaccination généralisée des futurs reproducteurs a considérablement réduit son incidence.
Toutefois le virus responsable de cette maladie semble être à l’origine d’une autre entité pathologique chez le canard de Barbarie, associant pancréatite et encéphalomyélite
L’agent de la maladie et son pouvoir pathogène
« L’hépatite virale du caneton » est causée par plusieurs entités virales dénommées Duck Hepatitis virus (DHV) -1, -2 ou -3 que l’on discrimine sur la base de spécificités sérologiques et de nuances anatomo-cliniques minimes.
Le DHV-1 est un virus de la famille des Picornaviridae : c’est un virus à ARN non enveloppé de 20 à 30 nanomètres de diamètre, constitué de 32 capsomères.
C’est un virus très résistant qui peut persister dans l’environnement 10 semaines à température ambiante.
La voie d’entrée est digestive, mais qui peut diffuser à de nombreux organes : foie, pancréas, voire même système nerveux central.
Les données épidémiologiques
La source du virus est représentée par les canards malades et les porteurs sains que sont les adultes. Les fientes et le milieu extérieur souillé sont également un bon réservoir, étant donné la résistance importante de ce type de virus.
Historiquement, seuls les canetons pékins ou mulards étaient réputés sensibles mais une nouvelle entité pathologique associée à un DHV a récemment été décrite chez le canard de Barbarie.
Le virus atteint donc exclusivement les jeunes animaux (1 à 3 semaines), mais les adultes restent porteurs. La transmission s’effectue d’animal à animal, de manière horizontale. La voie d’entrée du virus est digestive. L’incubation, très rapide, dure 2 à 4 jours.
Les manifestations cliniques de la maladie
Symptômes
La clinique est souvent spectaculaire, sans réels prodromes. Une mortalité importante se met rapidement en place, associée ou non à des signes nerveux (trémulations, oscillations de la tête, opisthotonos).
Lésions
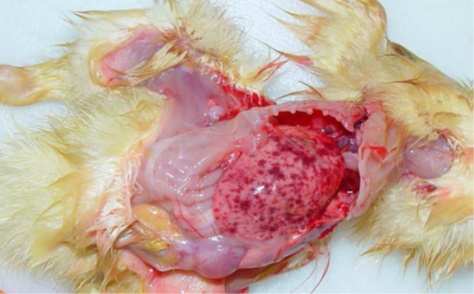
- Chez le caneton pékin ou mulard : au niveau macroscopique, le tableau nécropsique est dominé par l’atteinte hépatique : hépatomégalie, pétéchies et suffusions hémorragiques à la surface et dans le parenchyme hépatique.
L’histologie révèle en général une hépatite dégénérative et nécrosante d’intensité et d’extension variables. Associée aux signes nerveux, il est montré une encéphalite non suppurée sur les autres organes, principalement rénales, sont inconstantes et peu intenses. - Chez le caneton de Barbarie : l’autopsie montre principalement une hypertrophie pancréatique, parfois visible au travers de la paroi abdominale. On relève également une splénomégalie et parfois une congestion hépatique discrète.
Au niveau histologique, les lésions pancréatiques consistent en une nécrose de désintégration touchant principalement le parenchyme exocrine. Les lésions nerveuses, multifocales, siègent principalement dans les hémisphères cérébraux et le cervelet. Elles correspondent respectivement à une gliose sévère avec satellitose, et en une nécrose neuronale avec sphéroïdes, démyélinisation et gliose). Des manchons périvasculaires à cellules lymphoplasmocytaires sont régulièrement associés aux lésions. La rate est en général hyperplasique et on trouve parfois quelques foyers nécrotiques discrets au niveau hépatique.
Le diagnostic
Diagnostic épidémio-clinique
C’est le principal diagnostic. L’apparition soudaine d’une mortalité importante chez de jeunes canetons, associée à des signes nerveux et des lésions hépatiques à l’autopsie permet quasiment un diagnostic de certitude. Si d’autres affections sont également responsables de forte mortalité subite chez le caneton (entérite virale, septicémie bactérienne, syndrome de mort subite, coccidiose et mycotoxicose), l’autopsie permet en général de conclure.
Diagnostic de laboratoire
L’avènement des techniques de biologie moléculaire l’a considérablement facilité. Actuellement, un test en RT-PCR classique, ciblé sur un gène spécifique du génome du virus de l’hépatite du caneton est disponible.

La prévention et le contrôle de la maladie
Traitement
Il n’existe pas de traitement spécifique. La mortalité s’atténue au-delà de l’âge de 4 semaines. L’amélioration du confort des animaux, l’utilisation d’antibiotiques pour limiter les infections secondaires, peut aider les survivants à passer le cap de l’infection.
Le virus est très résistant dans le milieu extérieur et les risques de contamination entre bâtiments contigus ou entre bandes successives imposent des mesures de biosécurité draconiennes. Il faudra veiller notamment à renforcer les protocoles de nettoyage et désinfection.
Vaccination
Un vaccin vivant atténué injectable est actuellement disponible en France (Hepatovax ND, Merial). Il permet une protection efficace du jeune lors de son administration dans les 1ères semaines de vie. (Dès 1 jour chez les canetons issus de parents non vaccinés). La vaccination des canes reproductrices avant l’entrée en ponte permet le transfert au caneton d’une immunité d’origine maternelle protectrice. Cette pratique, aujourd’hui totalement généralisée, est à l’origine d’une très forte diminution du nombre de cas sur le terrain.







